共通テスト「化学」全問解説
2021年度(令和3年度)大学入学共通テスト 本試

どこよりも詳しく、わかりやすい過去問の分析と解説(解説動画付き)
第3問 無機化合物
第3問 問1 塩化ナトリウムの融解塩電解
模式図をかいて、それをみながら考えた方が速いです。
融解塩電解ですが、あくまで「模式図」なので細かいことは気にすることないです。
水溶液の電気分解と同じく、電流の向きと電極が確認しやすい図にしましょう。

こんなものでいいです。むしろ、わかりやすいように、このくらいがいいです。
ただし、融解塩電解なので、下の部分は水溶液ではありません。
水分子(H₂O)は含まれず、ナトリウムイオン(Na⁺)と塩化物イオン(Cl⁻)だけが存在しています。
(さらに正確にいえば、この操作は空気(酸素)に触れない状態で行われます。)
それでは、選択肢をみていきましょう。
先ほども述べましたが、こういうタイプの問題では、正解の選択肢は明らかな(判断しやすい)誤りを含んでいるのがパターンです。選択肢を順にみていけばいいですが、少しでも迷ったら、ためらわずに保留にすればいいです。(なお、問題そのものが、選択肢の順に検討していけば考えやすいようにつくられています。)
選択肢①:先ほどつくった図の、陰極のところに「Fe(鉄)」、陽極のところに「黒鉛(C)」と書き込んでみましょう。
電流の正体は、電源の-極から+極に移動する電子(e⁻)の流れです。
陰極には、どんどん電子が送り込まれてきますし、陽極では、電子が離れていく反応が起こります。
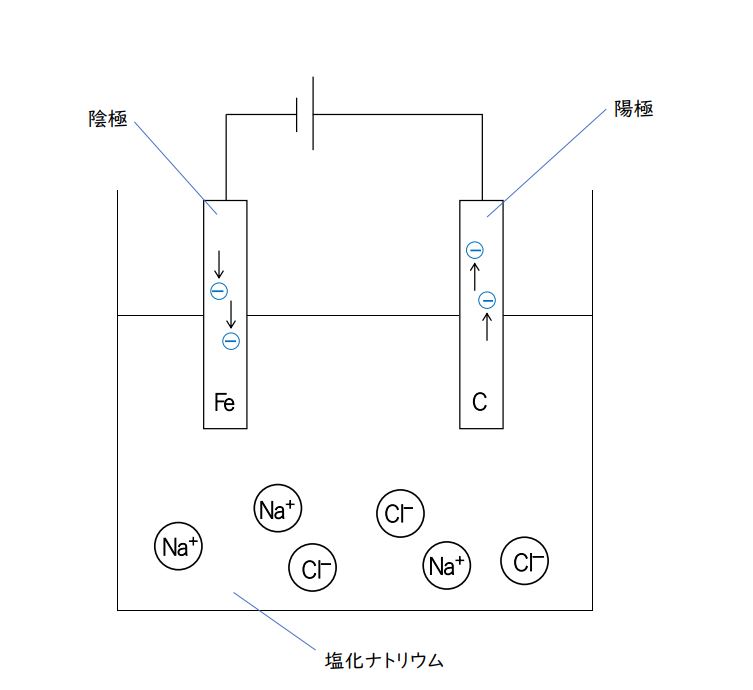
問題ないですね。
「もし、逆だったら・・・」を想定すると、判断しやしです。
もし、陽極がFe(鉄)であったら、直接電源につながれている鉄から先に電子が奪われます。
「Fe → Fe²⁺ + 2e⁻」などの反応が起こり、鉄がイオンとなって溶けだしていく反応が起こるかもしれません。
でも、ここでは鉄は陰極なので、特に問題はありません。鉄は、イオンになるとしたら陽イオンになります。
いくら電子が送り込まれてきても、影響されません。
なお、解説は加えましたが、実際のテストのとき、すぐに判断できなければ、「保留」ということで、全然いいですよ。
選択肢②:図をみて考えればよいです。
陰極には-の電気をもった電子が送られてきます。
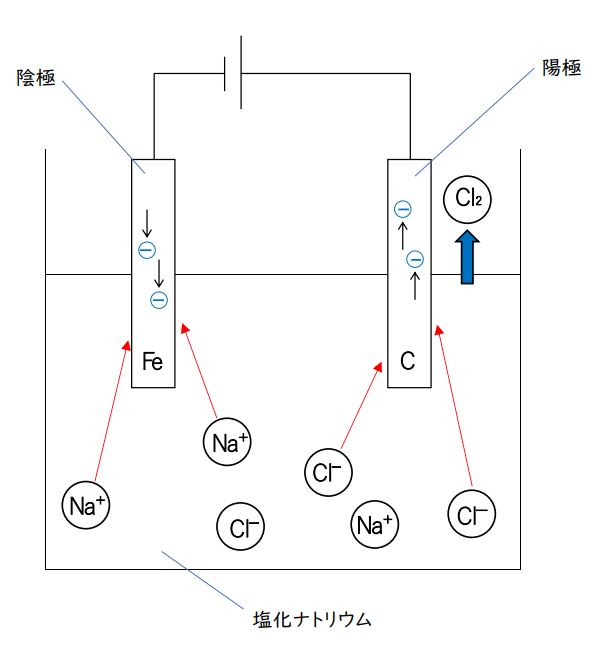
融解塩の中には水分子がないので、このマイナスの電気をもった電子を引き受けられるのは、陽イオンであるナトリウムイオン(Na⁺)しかありません。
よって、陰極では・・・
「Na⁺ + e⁻ → Na」の反応が起こり、単体のナトリウムが生成します。(下図参照)
一方、陽極では電子を奪う反応が起こりますが、融解塩の中に-の電気の電子を余分に持っていて離しやすい塩化物イオン(Cl⁻)があります。
塩化物イオンが陽極にひきよせられ、そこで電子を離し塩素原子にもどり、それが2つくっついて塩素分子(Cl₂)となり発生します。(下図参照)
反応式は、「2Cl⁻ + 2e⁻ → Cl₂」です。
よって、この選択肢は正しいです。
選択肢③:生成する物質の物質量の関係を確認したいので、この融解塩電解全体の化学反応式をつくりましょう。選択肢②で確認したように、「塩化ナトリウム」が分解し、「ナトリウム」と「塩素」が生成します。
左右の原子の数を、係数で合わせて・・・
「2NaCl → 2Na + Cl₂」・・・と、なります。
係数が反応する(生成した)物質の物質量の比を表しますので、この反応式からわかることは・・・
「ナトリウムの単体が2mol生成するとき、気体の塩素が1mol生成する。」・・・ということです。
この選択肢が、明らかにあやまりです。(ほらね。明らかだったでしょ?)
選択肢④も確認しておきましょう。これも大切なことがらです。
ナトリウム(Na)はアルカリ金属で、イオン化傾向がたいへんに大きいです。
また、イオン化傾向が大きいということは、単体ではいられにくい、ということです。
天然に、ナトリウムの単体なんて存在していません。
すべて、化合物の成分やイオンとして存在しています。
ですので、ナトリウムの単体を得る・・・というのは、ものすごくたいへんな操作です。
高校の化学室の装置では無理でしょう。
塩化ナトリウム水溶液を電気分解しても、陰極では水分子が引き寄せられ電子を受けとって、「水素(H₂)」が発生します。(「2H₂O + 2e⁻ → H₂↑ + OH⁻」)
では、単体のナトリウムを得るためにはどうすればよいか?
・・・ということで考えられたのが融解塩電解です。
化合物である「塩化ナトリウム(NaCl)」を高温で融解し、それを直接電気分解すれば、その中に含まれているのはナトリウムイオン(Na⁺)と塩化物イオン(Cl⁻)だけなので、ナトリウムの単体が得られるということです。
正解:③
選択肢①解説補足:これがもし逆で、陽極が鉄だったとしても、何の問題もありません。
なぜなら、この融解塩電解の目的は、ナトリウムの単体を得ることだからです。
塩素の単体なんて、他の方法(例:塩化ナトリウム水溶液の電気分解など)で、簡単に得られます。
陰極を鉄にすると、塩素が発生する代わりに鉄がイオン化するかもしれませんが、そんなことはどうでもいいということです。
・・・「正解の(誤りを含む)選択肢は明らかな誤りを含んでいる」、「①のような選択肢は、どんどん『保留』にすればよい」・・・とは、こういうことをふまえて、言っています。
第3問 問2 金属のイオン化傾向
Ⅰ:「金属のイオン化傾向」は、周期表と同じくらい大切です。
これが入っていないと、多くの化学的ことがらを解釈できません。
こういう問題が出たら、まず与えられた元素をイオン化傾向の順に書き出してみましょう。
これは、必須(必ずやらなければいけない)の作業です。
次のようになります。
「 Zn , Sn , Pb , (H) , Ag 」
・・・((H)より大きいか小さいかが、もっとも重要ですし、覚えるときもこれを基準に覚えるものなので、(H)も入れておきましょう。)
「イオン化傾向が大きい」ということは、「反応性に富む(反応しやすい)」・・・ということです。
「希硫酸に溶ける」というのも反応なので、希硫酸と反応したア、イが左から2つのZn(亜鉛)とSn(スズ)、反応しなかったウ、エがその後のPb(鉛)とAg(銀)だと判断してよいです。
(注:正確にいうと、(H)の左側(イオン化傾向が強い側)が、希塩酸や希硫酸と反応するグループです。鉛も希硫酸に反応しますが、反応してできる硫酸鉛(PbSO₄)は水に溶けにくく、鉛の表面がこれで覆われてしまうので、ほとんど反応が進まず、鉛は硫酸にほとんど溶けません。また、同じようなしくみで、塩酸にも溶けません。)
Ⅱ:ウなのでPbかAgなのですが、2価の塩化物というので、PbCl₂(塩化鉛)のことです。
Agの塩化物はAgCl(塩化銀)で、1価です。
この時点で、ウがPb、エがAgと決まります。
なお、この「熱水には溶ける」という部分は、「陽イオンの分離と確認」操作の単元で、重要になってくる内容です。
銀イオン(Ag⁺)と鉛イオン(Pb²⁺)は、塩酸を加えると、ともに白色沈殿を生じます(AgClとPbCl₂)。
これを分離するために、PbCl₂は熱水に溶けるという性質を(AgClは熱水にも溶けません)利用します。
AgClとPbCl₂を含む水溶液に熱水を加えると、Pb²⁺は水溶液中に溶け出し、AgClは沈殿として残るので、分離することができます。
Ⅲ:ウはPbですので、Pbの同族元素はZnとSnのどちらか?・・・ということになります。
もちろん、周期表のそんな下の方まで覚えておく必要はありません。
でも、学校の無機物質の単元の授業でスズ(Sn)と鉛(Pb)は、同じところで扱いましたよね。
スズと鉛は、同じ14族の元素です。
イオン化傾向列でもスズと鉛はとなりですし、記憶があいまいでも、そういうところから同族元素だろうと判断して大丈夫です。
正解 ア:③ イ:④
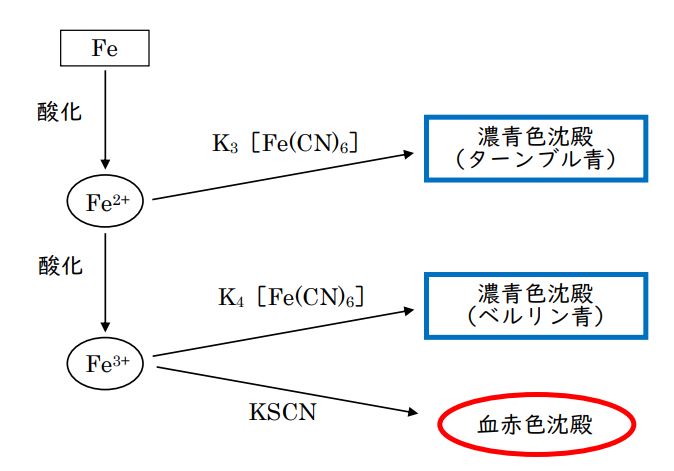
第3問 問3a 鉄(Ⅱ)イオン(Fe²⁺)の検出
鉄(Ⅱ)イオン(Fe²⁺)と鉄(Ⅲ)イオン(Fe³⁺)の検出には、それぞれ対になる酸化数の鉄原子を含む、ヘキサシアニド鉄(Ⅲ)酸カリウムとヘキサシアニド鉄(Ⅱ)酸カリウムの水溶液を加えます。
どちらも濃青色の沈殿を生じます。それぞれ「ターンブル青」、「ベルリン青」といいます。
(Ⅱ)には(Ⅲ)、(Ⅲ)には(Ⅱ)ということなので、覚えやすいはずです。
ヘキサシアニド鉄(Ⅲ)酸カリウムの化学式は、K₃[Fe(CN)₆](Feの酸化数は「-3」)、
ヘキサシアニド鉄(Ⅱ)酸カリウムの化学式は、K₄[Fe(CN)₆](Feの酸化数は「-2」)、です。
「CN」の酸化数が「-1」と考えると、Kの数から、このFeの酸化数-3、と-2も解釈できます。(CNの酸化数がなぜ-1とできるかについては、きりがないのでここでは省略します。「電気陰性度をもとにした酸化数の定義」で、解釈できます。プレテスト「化学基礎」で、わかりやすく説明していましたので、そちらを紹介しておきます。プレテスト「化学基礎」の解説記事はこちらです。この中の第2問です。)
選択肢③のK₃[Fe(CN)₆]に含まれるFeの酸化数を確認すると「+3」になっています。
2価のFe²⁺を検出したいので、これが正解です。
正解:③
選択肢④:Fe³⁺イオンが含まれている溶液に、チオシアン酸カリウム(KSCN)水溶液を加えると、血赤色の溶液になります。印象的な色なので、こちらもFe³⁺の検出試薬として重要です。
(Fe²⁺とFe³⁺の検出反応については、最後に図にまとめます。)
選択肢①は「硫化水素H₂Sによる陽イオンの分離操作」に関連することですし、選択肢④は有機化合物の話で、まったく関係ないフェイクの選択肢かと思いましたが、そうでもないですね。
Fe²⁺、Fe³⁺、ともに塩基性の条件下で、硫化水素と反応し黒色の沈殿をつくります。
Fe³⁺はH₂Sの還元作用によりFe²⁺になってから反応しますので、どちらもできる沈殿はFeSです。
ただし、塩基性条件とは書いてありませんね。酸性条件と仮定してもいいはずです。
酸性条件では、Fe²⁺は硫化水素を加えても反応しません。
Fe³⁺を含む酸性の水溶液に硫化水素を加えると、Fe³⁺が硫化水素に還元されてFe²⁺になる反応だけが起こり、Fe²⁺はこれ以上変化しません。
一方、Fe³⁺が還元されると同時にH₂Sの中のS(S²⁻)が酸化されて、硫黄Sが生じます。
硫黄Sが生じるので、水溶液はにごります。
ですので、もし設問が「Fe³⁺が含まれていることを確かめる操作」だったら、この選択肢もまちがっているとは言い切れない、ということになります。
また、選択肢④:サリチル酸は、フェノール性ヒドロキシ基-OHを持っているので、塩化鉄(Ⅲ)水溶液によって呈色します。
塩化鉄(Ⅲ)による呈色は、鉄(Ⅲ)イオンFe³⁺によるものなので、これも、もし設問が、「Fe³⁺が含まれていることを確かめる操作」だったら、この選択肢もまちがっているとは言い切れない、ということになります。
共通テストは、練りに練られてつくられていますので、過去問を使った勉強では、こういうところまで突き詰めておくのが効果的でしょう。
なお、この設問が、もし「Fe³⁺が含まれていることを確かめる操作」だったとしても、Fe³⁺の検出試薬としては、ヘキサシアニド鉄(Ⅱ)酸カリウム(K₄[Fe(CN)₆])やチオシアン酸カリウム(KSCN)などが一般的なので、こちらが出題されます。
選択肢①や②のように、奇をてらったもの(理屈だけで考えて、まちがいとは言い切れないもの)が正解として出題されることは、まず、ないので、ご安心ください。公のテストですからね。
第3問 問3b 化学反応式と物質量の比
式⑴だけをみて、考えればいいです。
また、「C₂O₄²⁻」を1つの原子団として、とらえることが、この問題のポイントです。
「酸化されてCO₂ になるC₂O₄²⁻ の物質量」は、直接は調べることはできませんが、左辺と右辺を比べてC₂O₄²⁻ が何mol減っているかを調べれば答えになります。
まず、問題の指定どおり式⑴で、[Fe(C₂O₄)₃]³⁻ が、1molあったことにしましょう。
化学反応式の係数が物質量の比を表しますので、式⑴は・・・
1molの[Fe(C₂O₄)₃]³⁻ から(左辺)、1molの[Fe(C₂O₄)₂]²⁻ と0.5molのC₂O₄²⁻ と1molのCO₂が生成する(右辺)ことがわかります。
左辺から、みていきましょう。「C₂O₄²⁻」にだけ、注目すればよいです。
[Fe(C₂O₄)₃]³⁻ 1つ(1mol)の中には、(C₂O₄)₃ なので、「C₂O₄²⁻」は3つ(3mol)含まれています。
左辺には、3molの「C₂O₄²⁻」があります。
次に右辺をみてみましょう。
まず、「[Fe(C₂O₄)₂]²⁻」とあります。
1つの錯イオンの中にある原子団「C₂O₄²⁻」の数が、3つから2つに減っています。
1molの[Fe(C₂O₄)₂]²⁻ が生成し、その中に含まれる「C₂O₄²⁻」の物質量は、1×2より2molです。
また右辺、錯イオンの次に「C₂O₄²⁻」が、0.5molあります。ここまでで、2.5molです。
残り3-2.5=0.5より、0.5molです。これが、CO₂に変化したC₂O₄²⁻ の物質量です。
「C₂O₄²⁻ → 2CO₂」の反応が起こりました。(正確には、この式の右辺には「+2e⁻」が入ります。式⑴では、左辺から右辺にかけてFeの酸化数が+3から+2に変化していて、その分です。)
1molの[Fe(C₂O₄)₃]³⁻ が反応するとき、0.5molのC₂O₄²⁻ が酸化されてCO₂になると確認できました。
正解:①
補足:「酸化されてCO₂ になるC₂O₄²⁻ 」は結局CO₂ になるので、式⑴のCO₂ との比較でも答えは出ますが、けっこう頭を使います。こちらの解法の方が、次の難しめの問題c の解法ともつながるのでいいです。
問題文の最初のページの「CO₂ に変化したC₂O₄²⁻ の量から」や、この設問で「酸化されてCO₂ になるC₂O₄²⁻ 」と、反応でなくなったC₂O₄²⁻ の方に着目するようにしているのは、出題者側の適切な誘導です。
第3問 問3c 還元された錯イオンの割合の導出
一見、難しそうですが、必要な情報を適切にとり出せれば、わりと簡単です。(それが、たいへんなんですけどね。)
まず、設問が何を言いたいのかを、しっかりと読みとりましょう。
今調べたいのは、反応し変化した[Fe(C₂O₄)₃]³⁻ の割合です。(もちろん、物質量の割合として処理してよいです。)
この問題全体で、言っているのは・・・
反応後に残った[Fe(C₂O₄)₃]³⁻ の物質量、または、反応後に生成した[Fe(C₂O₄)₂]²⁻ の物質量が調べられるものならば、その数値を使って、反応で変化した[Fe(C₂O₄)₃]³⁻ の割合は、直接すぐに計算できます。
例えば、これがもっとも直接的ですが、 反応後に生成した[Fe(C₂O₄)₂]²⁻ の物質量を調べた場合・・・
反応式から、1molの[Fe(C₂O₄)₃]³⁻ から、1molの[Fe(C₂O₄)₂]²⁻ が生成します。
反応で生成した[Fe(C₂O₄)₂]²⁻ の物質量がそのまま、反応した[Fe(C₂O₄)₃]³⁻ の物質量ということになります。
よって、「(反応で生じた[Fe(C₂O₄)₂]³⁻ の物質量)/(反応前の[Fe(C₂O₄)₃]²⁻ の物質量)〔(反応前の[Fe(C₂O₄)₃]³⁻ の物質量)分の(反応で生じた[Fe(C₂O₄)₂]²⁻ の物質量)〕」で割合が求められます。(百分率なので、これに100をかけて答えです。)
(反応前の[Fe(C₂O₄)₃]³⁻ の物質量)は、わかりますし問題文でも0.0109molと与えられています。
ところが、(反応で生じた[Fe(C₂O₄)₂]²⁻ の物質量)〔あるいは反応後に残った[Fe(C₂O₄)₃]³⁻ の物質量〕、を調べるのは、無理っぽいです。
そこで、別の方法をとることになりました。
設問の文章中にある説明では・・・
「CO₂に変化したC₂O₄²⁻ の量」から、「反応した[Fe(C₂O₄)₃]³⁻ の物質量(=反応で生じた[Fe(C₂O₄)₂]²⁻ の物質量)」を調べる方針で行くようです。
また、設問の流れも重視しましょう。
b問題で、[Fe(C₂O₄)₃]³⁻ が1mol完全に反応すると、C₂O₄²⁻ 0.5molが酸化されCO₂ に変化することを確認しました。
逆にいえば、CO₂に変化したC₂O₄²⁻ の物質量を求めれば、それを2倍した物質量が、反応した[Fe(C₂O₄)₃]³⁻ の物質量と決まります。
ということで、問題文に書かれているとおり、「CO₂に変化したC₂O₄²⁻ の量」を調べる方針で進めましょう。
ただし、「CO₂に変化したC₂O₄²⁻ の量」は直接は調べられません。
実験Ⅱの内容を、よく見直していみましょう。
2種類の錯イオン[Fe(C₂O₄)₃]³⁻ と[Fe(C₂O₄)₂]²⁻ からは、C₂O₄²⁻ を完全に遊離させることが、できるようです。
また、「CO₂に変化しなかったC₂O₄²⁻ の量」は調べられるらしく、それを使えば確かに「CO₂に変化したC₂O₄²⁻ の量」を調べられますね。
では、反応前後のC₂O₄²⁻ の物質量を、みていきましょう。
問題がよく出てきて、b問題と同じように調べられます。
反応前:錯イオン[Fe(C₂O₄)₃]³⁻ は1分子の中に原子団C₂O₄²⁻ を3つ持っています。
この錯イオン0.0109molを用いて実験を行ったので、最初に存在したC₂O₄²⁻ の物質量は、0.0109mol×3より、0.0327molです。
反応後:水溶液中のすべてのC₂O₄²⁻ が、カルシウムイオン(Ca²⁺)と塩(えん)をつくり、水和物として沈殿します。
この水和物について、質量と式量が与えられているので、物質量が計算できます。
146÷4.38=0.03より、0.03molです。
水和物の化学式はCaC₂O₄・H₂Oなので、水和物1分子の中にC₂O₄²⁻ も1つ含まれています。
よって、反応後に残っていたC₂O₄²⁻ の物質量も、0.03molとわかりました。
したがって、「CO₂に変化したC₂O₄²⁻ の量」は、0.0327-0.03=0.0027より、0.0027molです。
よって、反応した[Fe(C₂O₄)₃]³⁻ の物質量は、その2倍で、0.0027×2=0.0054より、0.0054molです。
これで、すべてそろいました。
もともとの、[Fe(C₂O₄)₃]³⁻ の物質量が0.0109mol、そのうちの0.0054molが[Fe(C₂O₄)₂]²⁻ に変化しました。もはや、この時点で答えは、わかります。だいたい半分くらいなので、50%ということでよいでしょう。
計算式も一応示しておきますと、求める割合は(注:分数はスラッシュ/で表します)、
「(0.0054/0.0109)×100=49.5...」より、50%です。
正解:④
以上です。ありがとうございました。
コメントなどいただけると、とてもうれしいです。
執筆:井出進学塾(富士宮教材開発) 代表 井出真歩
お問い合わせ
電話番号
0544-54-3412
受付時間:午前9時~午後10時(毎日、授業しております。)
ホームページをみた、と言ってください。
井出進学塾
富士宮市上井出344-1
ぴ (日曜日, 08 12月 2024 12:30)
解説の天才
井出進学塾 (土曜日, 31 12月 2022 16:50)
to あき 様
励みになるコメントを、ありがとうございます。
申し訳ありません。2022年の追試までは、時間的に無理かと思います。
2022年の本試の方は、すでに上げていますので、そちらもよろしければどうぞ。
https://sidouhouannai.jimdo.com/%E9%AB%98%E6%A0%A1%E7%94%9F/%E5%85%B1%E9%80%9A%E3%83%86%E3%82%B9%E3%83%88-%E5%8C%96%E5%AD%A6-%E8%A7%A3%E8%AA%AC-2022%E5%B9%B4%E5%BA%A6-%E4%BB%A4%E5%92%8C4%E5%B9%B4%E5%BA%A6-%E6%9C%AC%E8%A9%A6/
第5問がまだですが、1月1・2日は時間が取れますので、動画だけでもあげておく予定です。
追試の方も、何かピンポイントでリクエストがあれば、応えられるかもしれません。
約束はできませんが、よかったらお知らせください。
あき (土曜日, 31 12月 2022 15:46)
今年受験する者です。解説見てもわかりづらかった問題が、文章プラス映像ですごく理解できました!
よろしければ2022の化学追試も解説していただけたら嬉しいです。
井出進学塾 (土曜日, 27 8月 2022 13:01)
to あっきーな 様
ご指摘感謝します。
どこかで誤植したものをいくつかコピペして回してしまっていました。
修正しました。
他の皆様にも、失礼しました。すみませんでした。
あっきーな (土曜日, 27 8月 2022 11:43)
大問3の問3の[Fe(C₂O₄)₂]³⁻ は3-ではなく2-ではないでしょうか。
井出進学塾 (金曜日, 09 4月 2021 16:06)
to元化学を勉強していた者 様
ご指摘ありがとうございます。
確かに「変化しなかった」は、「変化した」の誤記でした。
修正させていただきました。
また、これまでこの解説に目を通してくださった方には、申し訳なかったです。
後半の内容については・・・
私も確かに最初は、2molのCO₂は1molのC₂O₄に由来する・・・というアプローチから解説しようと思いましたが、この方が問題の意図にあっているかな?と思い、このような解説にしました。
少し迷いもあり、また後で検討し直そうとは思っていたところです。
こう、ご指摘をもらうと、やはり少し考えすぎだったかな・・・という気がしてきています。
もう少し検討してから、修正するなり、補足解説として別解釈を入れるなどしたいと思います。
ありがとうございました。
元化学を勉強していた者 (金曜日, 09 4月 2021 12:36)
丁寧な解説、大変有り難うございました。助かります。。。
(何年かぶりにセンター試験級の入試問題を説明しなくてはならず、参考にさせて
いただきました)
一点、もしかすると間違いでは無いかと思った部分があったので、ご連絡させて頂き
ます。(私の勘違いの場合は、ご容赦ください)
----------
問3 3c 還元された錯イオンの割合の導出
「したがって、「CO₂に変化しなかったC₂O₄²⁻ の量」は、0.0327-0.03=0.0027より、0.0027molです。」
と記載がありますが、「CO₂に変化したC₂O₄²⁻ の量」ではないでしょうか?
C₂O₄²⁻→2CO₂
から求められたC₂O₄²⁻(CO₂に変化し、系に存在しなくなったC₂O₄²⁻)のモル数と
モル比からCO₂のモル数が0.0054と求められるのではないでしょうか?
※この問題は「C₂O₄²⁻→2CO₂」に気が付けるかどうかが鍵だと勝手に思っています。
(大変良い問題です、、、)
以上、失礼しました。